พลังงานยึดเหนี่ยว
Binding Energy |
สุรศักดิ์ พงศ์พันธุ์สุข
กลุ่มวิจัยและพัฒนานิวเคลียร์
สถาบันเทคโนโลยีนิวเคลียร์แห่งชาติ (องค์การมหาชน) |
เมื่อตอนเริ่มต้นศตวรรษที่ 20 ในปี 1905 แอลเบิร์ต ไอน์สไตน์ (Albert Einstein) ได้เสนอ ทฤษฎีสัมพัทธภาพพิเศษ (special theory of relativity) ซึ่งมีสมการหนึ่งอยู่ด้วยเรียกว่า สมการมวล-พลังงาน ซึ่งทำให้ตีความได้ว่า มวลและพลังงานเป็นสิ่งเดียวกัน ที่สามารถแปลงไปมาระหว่างกันได้ และเพราะว่าแสง มีความเร็วสูงมาก ซึ่งตามสมการนี้มวลเพียง 1 กรัมจะกลายเป็นพลังงานได้ถึง 900 ล้านล้านล้านเอิร์ก ซึ่งสามารถทำให้ หลอดไฟขนาด 100 วัตต์ส่องสว่างได้นานถึง 35,000 ปี
ทศวรรษ 1920 ฟรานซิส วิลเลียม แอสตัน (Francis William Aston) ได้พัฒนาสเปกโทรมิเตอร์มวล (mass spectrometer) ใช้ทดลองหาน้ำหนักของอะตอมหรือไอโซโทปต่าง ๆ ในขณะนั้นเป็นที่ทราบกันแล้วว่าอะตอม ประกอบด้วย อิเล็กตรอน (ค้นพบโดยโจเซฟ ทอมสันเมื่อปี 1897) ที่หนักเพียง 1 ใน 1,837 เท่าตัวของโปรตอน แล้วก็ยังทราบว่าอะตอมมีแกนกลางเล็ก ๆ เรียกว่านิวเคลียส (ค้นพบโดยเออร์เนสต์ รัทเทอร์ฟอร์ดในปี 1911) ที่มีประจุเป็นบวกจากประจุของโปรตอน และการที่อะตอมไม่มีประจุก็แสดงว่าจำนวนโปรตอนในนิวเคลียสเท่ากับจำนวน อิเล็กตรอนที่โคจรอยู่รอบ ๆ นิวเคลียส (แต่ในขณะนั้นยังไม่รู้ว่าในนิวเคลียสยังประกอบด้วยนิวตรอนที่ไม่มีประจุอยู่ด้วย ซึ่งค้นพบโดยเจมส์ แชดวิกในปี 1932) |

|

|
แอลเบิร์ต ไอน์สไตน์ |
ฟรานซิส แอสตัน |
|
จากการทดลองของแอสตัน ชึ่งเมื่อเขาได้หาน้ำหนักของอะตอมและไอโซโทปมากชนิดขึ้นและหาอย่างละเอียด (ทศนิยมหลายตำแหน่ง) แล้ว ก็ได้พบกับเรื่องประหลาดว่า น้ำหนักของอะตอมซึ่งก็คือน้ำหนักของนิวเคลียสของมัน (หากไม่สนใจน้ำหนักของอิเล็กตรอนซึ่งเบามากดังกล่าวแล้วข้างต้น) ที่เชื่อว่าเกิดจากโปรตอนมารวมตัวกันนั้น มีน้ำหนักน้อยกว่าน้ำหนักของโปรตอนอิสระรวมกัน เช่น พบว่านิวเคลียสของฮีเลียมหนักเท่ากับ 4.00280 u (คิดเฉลี่ยโปรตอนในนิวเคลียสหนักเท่ากับ 1.0007 u) ในขณะที่น้ำหนักของโปรตอน 4 อนุภาครวมกันเท่ากับ 4.03032 u (โปรตอนอิสระหนักเท่ากับ 1.00758 u) คิดเป็นมวลที่หายไปเท่ากับ 0.02752 u (ได้จาก 4.03032 - 4.00280) ซึ่งหากคำนวณตามสมการมวล-พลังงานก็จะได้พลังงานมหาศาล และหากคิดในทางกลับกันว่า ถ้าเราต้องการทำลาย นิวเคลียสของฮีเลียมให้กลับเป็นโปรตอนอิสระ 4 อนุภาค ก็ต้องใช้พลังงานจำนวนนี้นั่นเองในการทำลาย ซึ่งพลังงาน จำนวนนี้จะแปลงกลับไปเป็นมวลส่วนที่ขาดหายไป
พลังงานจำนวนนี้จึงถูกมองในอีกแง่หนึ่งว่าเมื่อโปรตอน 4 อนุภาคมารวมกันเข้าเป็นนิวเคลียสของฮีเลียม มวลส่วนหนึ่งก็จะถูกแปลงไปเป็นพลังงานสำหรับยึดโปรตอนเข้าไว้ด้วยกัน เรียกว่า พลังงานยึดเหนี่ยว (binding energy) ซึ่งมวลปริมาณนี้สามารถคำนวณได้ว่าเป็นพลังงานเท่าใดด้วย สมการมวล-พลังงาน ของไอน์สไตน์ นั่นคือ
พลังงานยึดเหนี่ยวของนิวเคลียส (nuclear binding energy) = D mc2
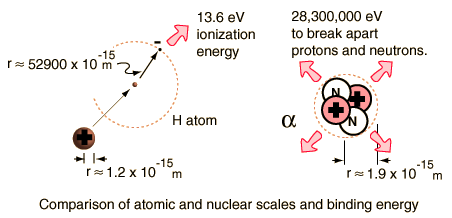
ในปัจจุบันเป็นที่ทราบกันแล้วว่า อนุภาคแอลฟามีองค์ประกอบคือ โปรตอน 2 อนุภาคกับนิวตรอน 2 อนุภาค ที่มารวมกันแล้วมวลลดลงไป D m = 0.0304 u กลายเป็นพลังงานยึดเหนี่ยวคิดเป็น 28.3 MeV (ดูรูปด้านล่างประกอบ และใช้การแปลงระหว่าง u กับ MeV ดังนี้ 1 amu = 931.46 MeV/c2 = 0.93146 GeV/c2) |
|
| ย้อนกลับมาที่แอสตันได้ทำการทดลองกับธาตุต่าง ๆ มากมายพอถึงปี 1927 เขาก็ได้ข้อสรุปว่า เมื่ออะตอมโตขึ้น การรวมตัวของโปรตอนในนิวเคลียสก็มีน้ำหนักรวมน้อยลงมากขึ้นเรื่อย ๆ (น้ำหนักเฉลี่ยของโปรตอนลดลงเรื่อย ๆ แสดงว่ามีมวลหายไปและกลายเป็นพลังงานยึดเหนี่ยวเพิ่มมากขึ้น) และน้อยลงมากที่สุดกับธาตุแถว ๆ ธาตุเหล็ก (คิดเฉลี่ยโปรตอนในนิวเคลียสหนักเพียง 0.9988 u) จากนั้นน้ำหนักรวมก็ค่อย ๆ กลับเพิ่มขึ้นอีก (น้ำหนักเฉลี่ยของ โปรตอนกลับเพิ่มขึ้นอีก) แสดงว่ากลุ่มธาตุเหล็กมีประสิทธิภาพการรวมตัวของโปรตอนภายในนิวเคลียสได้แน่นที่สุด กล่าวคือ มีพลังงานยึดเหนี่ยวสูงที่สุด นั่นเอง |
|
กราฟ พลังงานยึดเหนี่ยวต่อนิวคลีออน ของธาตุที่มีในธรรมชาติ จุดสูงสุดอยู่แถว ๆ ธาตุเหล็ก |
| |
|
ระบุบริเวณของธาตุที่อาจจะเกิดฟิวชันและฟิชชันได้ |
|
เมื่อลองพิจารณาพลังงานยึดเหนี่ยวจากผลการทดลองของแอสตันก็จะพบว่า มันยังบอกนัยด้วยว่า ถ้าสามารถแตก นิวเคลียสที่มีมวลมาก ๆ (ในรูปคือ นิวเคลียสทางปลายด้านขวาของเส้นกราฟ) ออกเป็นนิวเคลียสที่เล็กลงได้ (fission) ก็จะมีมวลส่วนหนึ่งแปลงเป็นพลังงานออกมา ในทำนองเดียวกัน หากเอานิวเคลียสที่เบามาก ๆ (ในรูปคือ นิวเคลียสทางปลายด้านซ้ายของเส้นกราฟ) มาหลอมรวมกันเป็นนิวเคลียสที่โตขึ้น (fusion) ก็จะมีมวลส่วนหนึ่งแปลงเป็นพลังงานออกมาเช่นกัน
ในรูปด้านล่าง ได้ยกตัวอย่าง การหลอมนิวเคลียส (fusion) ของไอโซโทปที่ใช้เป็นเชื้อเพลิง 2 ชนิดคือ ดิวเทอเรียม (deuterium) กับ ทริเทียม (tritium) เปรียบเทียบกับ การแบ่งแยกนิวเคลียส (fission) ของเชื้อเพลิง ยูเรเนียม-235 โดยเปรียบเทียบในรูปของพลังงานที่ปลดปล่อยออกมา (energy yield) และสามารถป้อนให้กับประชากรอเมริกัน ใช้ได้กี่คน (การใช้พลังงานต่อหัวของชาวอเมริกัน คือ 5 x 1011 จูล) สรุปได้ดังนี้ |
| |
การหลอมนิวเคลียส |
การแบ่งแยกนิวเคลียส |
| พลังงานที่ปลดปล่อยออกมา (energy yield) ต่อครั้ง |
17.6 MeV |
เฉลี่ยเท่ากับ 215 MeV |
| พลังงานที่ปลดปล่อยออกมา (energy yield) ต่อเชื้อเพลิง 1 กิโลกรัม |
3.38 x 1014 จูล |
8.80 x 1013 จูล |
| พอเพียงสำหรับการใช้ของประชากรอเมริกัน |
676 คน |
176 คน |
|
|
สำหรับการแตกสลายตามธรรมชาติของนิวเคลียส (radioactive decay) ที่มีมวลมาก ๆ ออกเป็นนิวเคลียสที่เล็กลง และมีมวลส่วนหนึ่งแปลงเป็นพลังงานออกมา เช่น จาก ปรากฏการณ์กัมมันตภาพรังสี (radioactivity) ของการสลายของยูเรเนียม-238 (มีมวลเท่ากับ 238.0506 u) เป็นตะกั่ว-206 (มีมวลเท่ากับ 205.9745 u) กับอนุภาค อีก 2 ชนิดคือ อนุภาคแอลฟา 8 อนุภาค (มีมวลรวม 8 x 4.0026 = 32.0208 u) และอนุภาคบีตา 6 อนุภาค (มีมวลรวม 6 x 0.00154 = 0.00924 u) ซึ่งแสดงว่าเมื่อนิวเคลียสของยูเรเนียม-238 สลายเป็นนิวเคลียสของตะกั่ว-206 กับอนุภาคแอลฟา 8 อนุภาคและอนุภาคบีตา 6 อีกอนุภาค ได้มีมวลหายไป 0.0461 u (238.0506 - 205.9745 - 32.0208 - 0.00924 = 0.0461) ซึ่งถูกแปลงไปเป็นพลังงานคือ รังสีแกมมา และพลังงานจลน์ของอนุภาคแอลฟา กับอนุภาคบีตา
อนึ่ง การที่อิเล็กตรอนถูกยึดไว้ในอะตอมได้ พลังงานนี้ก็เรียกว่าพลังงานยึดเหนี่ยวเช่นกัน แต่พลังงานยึดเหนี่ยวของ นิวเคลียสนั้น สูงกว่าพลังงานยึดเหนี่ยวของอิเล็กตรอนต่ออะตอมเป็นอันมาก ในระดับหลายล้านเท่าตัว ยกตัวอย่าง พลังงานยึดเหนี่ยวของอนุภาคแอลฟาเท่ากับ 28.3 MeV ดังกล่าวแล้วข้างต้น ในขณะที่พลังงานที่โมเลกุลไฮโดรเจน ใช้ในการแตกตัวเป็นไอออน (Ionization energy of atomic hydrogen) มีค่าเพียง 13.6 eV (ดูรูปประกอบด้านล่าง) |
|
| โพสต์เมื่อ : 28 กุมภาพันธ์ 2554 |
| |