เมื่อ R เป็นอัตราส่วนของไอโซโทปหนัก (heavy) กับไอโซโทปเบา (light) ในตัวอย่างกับสารมาตรฐาน สำหรับธาตุซัลเฟอร์ คาร์บอน ไนโตรเจน และออกซิเจน ค่าเฉลี่ยของอัตราส่วนไอโซโทปหนักต่อไอโซโทปเบาบนพื้นโลก อยู่ในช่วงตั้งแต่ 1:22 ในซัลเฟอร์ ไปจนถึง 1:500 ในออกซิเจน อัตราส่วนของ 2H:1H คือ 1:6410 ค่าของ d ที่เป็นบวก หมายความว่า ตัวอย่างมีไอโซโทปหนักมากกว่าสารมาตรฐาน และค่าของ d ที่เป็นลบ หมายความว่า ตัวอย่างมีไอโซโทปหนักน้อยกว่าสารมาตรฐาน เช่น d ของ 15N เท่ากับ +30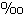 หมายความว่า สารตัวอย่างมีไอโซโทป 15N มากกว่าสารมาตรฐาน 30 ส่วนในพันส่วน หรือ 3% หมายความว่า สารตัวอย่างมีไอโซโทป 15N มากกว่าสารมาตรฐาน 30 ส่วนในพันส่วน หรือ 3%
เดลตา นี้ ใช้สัญลักษณ์แทนด้วยอักษรกรีกตัวเล็ก d โดยทั่วไปจะไม่แทนด้วยอักษร "d" สัญลักษณ์ d ออกเสียงว่า เดลตา (delta) โดยจะไม่ออกเสียงว่า del เนื่องจาก del ใช้หมายถึง ตัวดำเนินการ (operator) ในอนุพันธ์ย่อย (partial derivative) ทางคณิตศาสตร์
หลักการพื้นฐาน
ไอโซโทปของธาตุหลายชนิด มีสัมบัติทางฟิสิกส์และทางเคมีแตกต่างกันเล็กน้อย เนื่องจากมวลที่ต่างกัน สำหรับธาตุที่เลขมวลต่ำ ๆ ผลต่างของมวลจะมีค่ามากพอที่จะมีผลต่อกระบวนการทางฟิสิกส์ ทางเคมี และทางชีววิทยา หรือเกิดการเปลี่ยนแปลงแยกลำดับส่วน(fractionate) ของไอโซโทป หรือมีการเปลี่ยนแปลงอัตราส่วนของแต่ละไอโซโทป กระบวนการสองชนิดที่ทำให้เกิดการเปลี่ยนแปลงการแยกลำดับส่วนของไอโซโทป (isotope fractionation) คือ สมดุลของไอโซโทป (equilibrium isotope) และจลนศาสตร์ของไอโซโทป (kinetic isotope) ผลของกระบวนการเปลี่ยนแปลงแยกลำดับส่วนไอโซโทปในน้ำและสารละลาย ทำให้มีปริมาณของไอโซโทปที่เป็นองค์ประกอบเฉพาะ (อัตราส่วนของไอโซโทปหนักต่อไอโซโทปเบา) ที่อาจใช้เป็นข้อมูลแสดงที่ผ่านมา หรือการเกิดกระบวนการใดที่ผ่านมา
equilibrium isotope fractionations ปฏิกิริยาแลกเปลี่ยนระหว่างสถานะหรือระหว่างสารประกอบ ทำให้อัตราส่วนไอโซโทปของธาตุเปลี่ยนไป ที่สภาวะสมดุล (equilibrium) อัตราการเกิดปฏิกิริยาไปข้างหน้า และปฏิกิริยาย้อนกลับของแต่ละไอโซโทปมีค่าเท่ากัน แต่ไม่ได้หมายความว่า องค์ประกอบของแต่ละไอโซโทปในสารประกอบ 2 ชนิดจะเท่ากัน เพียงแต่อัตราส่วนของแต่ละไอโซโทปในสารประกอบแต่ละชนิดมีค่าคงที่ ในระหว่างที่อัตราการเกิดปฏิกิริยาสมดุล (equilibrium reactions) โดยทั่วไป ในสารประกอบที่มีสถานะพลังงาน (energy state) สูงกว่า จะมีไอโซโทปหนักกว่าในปริมาณมากขึ้น (enrich) ตัวอย่างเช่น สารประกอบซัลเฟต (sulfate) มี 34S มากกว่า (enrich) เมื่อเทียบกับสารประกอบซัลไฟด์ (sulfide) หรือกล่าวได้อีกอย่างหนึ่งว่าซัลไฟด์มี 34S น้อยกว่า (deplete) เมื่อเทียบกับซัลเฟต
เมื่อมีการเปลี่ยนสถานะ อัตราส่วนของไอโซโทปหนักกับไอโซโทปเบา ในโมเลกุลของสองสถานะจะเปลี่ยนไป ตัวอย่างเช่น เมื่อไอน้ำกลั่นตัวเป็นหยดน้ำ ไอโซโทปที่หนักกว่าของน้ำ (18O และ 2H) จะมีมากขึ้นในสถานะของเหลว ขณะที่ไอโซโทปเบา (16O และ 1H) มีแนวโน้มจะอยู่ในสถานะที่เป็นไอ (vapor) มากกว่า
kinetic isotope fractionations เกิดขึ้นกับระบบที่ไม่มีสมดุลไอโซโทป (isotopic equilibrium) โดยอัตราการเกิดปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับไม่เท่ากัน และปฏิกิริยาอาจมีลักษณะไปทางเดียว ถ้ามีผลผลิต (product) เกิดขึ้นและแยกออกจากปฏิกิริยา อัตราการเกิดปฏิกิริยาขึ้นกับอัตราส่วนมวลของไอโซโทป และพลังงานในการสั่น (vibrational energy) ซึ่งเป็นไปตามกฎทั่วไป ที่พันธะ (bond) ระหว่างไอโซโทปที่เบากว่า จะหลุดออกง่ายกว่าพันธะระหว่างไอโซโทปที่หนักซึ่งแข็งแรงกว่า ไอโซโทปที่เบากว่าจึงเกิดปฏิกิริยาได้มากกว่า ทำให้มีความเข้มข้นในผลผลิตมากกว่า ขณะที่ไอโซโทปที่หนักจะอยู่ในตัวทำปฏิกิริยา (reactant) ตั้งต้นมากกว่า
กระบวนการทางชีววิทยา โดยทั่วไปจะเป็นแบบทิศทางเดียว และเป็นตัวอย่างที่ดีของ ปฏิกิริยาของไอโซโทปแบบจลน์ หรือ "kinetic" อวัยวะต่าง ๆ มีแนวโน้มที่จะใช้ไอโซโทปเบามากกว่า เนื่องจากใช้พลังงานที่ต่ำกว่า ทำให้เกิดการแยกลำดับส่วน (fractionations) ระหว่างตัวทำปฏิกิริยาตั้งต้น (ซึ่งหนักกว่า) กับผลผลิต (ซึ่งเบากว่า) ระดับของการแยกลำดับส่วนขึ้นกับวิถีปฏิกิริยา (reaction pathway) และพลังงานในการเกิดพันธะของปฏิกิริยา โดยทั่วไป ปฏิกิริยาที่ช้ากว่า จะทำให้เกิดการแยกลำดับส่วนของไอโซโทปมากกว่าปฏิกิริยาที่เร็วกว่า เนื่องจากอวัยวะมีเวลาในการเลือกได้มากขึ้น ปฏิกิริยาแบบจลน์หรือ kinetic สามารถทำให้เกิดการแยกส่วนที่แตกต่างกัน และเกิดขึ้นได้มากกว่าปฏิกิริยาแบบสมดุลหรือ equilibrium
มีหลายปฏิกิริยาที่สามารถเกิดขึ้นได้ ภายใต้สภาวะสมดุล (equilibrium) หรือได้รับผลกระทบมากขึ้นจากปฏิกิริยาการแยกลำดับส่วนของไอโซโทปแบบจลน์ ตัวอย่างเช่น การระเหยสามารถเกิดขึ้นได้ภายใต้สภาวะสมดุล (ที่ความชื้น 100% โดยยังมีอากาศ) หรือผลผลิตมีการแยกออกจากตัวทำปฏิกิริยาตั้งต้นมากขึ้น (เช่น ไอน้ำถูกพัดไปตามลม) ภายใต้สภาวะเหล่านี้ องค์ประกอบของไอโซโทปของน้ำและไอน้ำ ได้รับผลกระทบจากการแยกลำดับส่วนไอโซโทปแบบจลน์เพิ่มขึ้นอีกหลายส่วน |